Desvendando o processo de Resistência tumoral adquirida através da modulação da resposta a IFNg
- Emmanuel Arthur A. Aragão

- 1 de abr. de 2021
- 3 min de leitura
Atualizado: 5 de abr. de 2021
As imunoterapias foram responsáveis por uma revolução no tratamento de diferentes tipos de tumores, reforçando ou ainda se apropriando de componentes da resposta imune e assim possibilitando uma ação mais imediata. Neste sentido, existem terapias com células T com receptor quimérico (CAR) – a qual consiste na indução de um receptor capaz de ativar a célula T – ou ainda com anticorpos biespecíficos (TCB), que são capazes de se ligar à célula T e a um antígeno tumoral determinado; em ambos os casos, as estruturas possibilitam a ativação de células T, que exercem um papel fundamental através da liberação de fatores pro-apoptóticos (1). Estas abordagens de tratamento têm papel reconhecido no tratamento de tumores, sobretudo hematológicos, possuindo aprovação para uso clínico no tratamento de linfomas e leucemias (1,2); entretanto, os tumores sólidos demonstram fatores limitantes para maior eficácia terapêutica. Entre estes, pode-se citar o microambiente imunossupressivo, regulação dos antígenos tumorais (como escape ao reconhecimento) além da hiper expressão de checkpoints imunes (1,3).
Neste contexto, o recente trabalho de Arenas e colaboradores (1) explorou o processo de resistência adquirida à imunoterapia por células tumorais. Para isto, os autores geraram uma linhagem resistente através de co culturas de células tumorais e PBMCs, tratadas com TCB por um período delimitado. Este protocolo possibilitou a recuperação de algumas células tumorais mediante a limitação da ação do tratamento; a repetição do processo por um longo período induziu a seleção e origem de uma nova linhagem de células, comprovadamente mais resistente ao tratamento em comparação à linhagem original, ainda que realizado de forma completa (figura 1).

Figura 01.Representação do modelo utilizado para indução de resistência. Fonte: Modificado de Arenas e colaboradores (2021).
Após a indução da linhagem resistente, foram realizados ensaios comparativos com a parental, sensível ao tratamento. Embora não tenham sido notadas grandes diferenças na produção de citocinas e de receptores de exaustão ou estimulatórios – a partir da co cultura de cada linhagem separadamente com células PBMC e o tratamento com TCB – a análise de expressão gênica apontou importantes vias de regulação do ciclo celular alteradas. Entre as vias alteradas, os autores voltaram a atenção para a resposta de IFNg, visto sua grande relação na regulação da resposta mediada por células imunes. O IFNg é uma citocina citotóxica normalmente produzida por células T e Natural Killer, sua ação ocorre através da dimerização de receptores IFNGR1 e IFNGR2, resultando na fosforilação de STAT1 que migra para o núcleo e resulta na ativação de genes relacionados à morte celular (4) (figura 2). Desta forma, foram utilizados bloqueadores de IFNg para investigar a sua relevância direta na indução da resistência ao tratamento e demonstraram que a linhagem, outrora sensível, tornou-se mais resistente somente pelo bloqueio; o mesmo indicio foi demonstrado através de metodologias diferentes. Em vista disso, através do silenciamento de cada componente da sinalização de forma separada, foi constatado que este fenômeno ocorre diretamente pela modulação de JAK2, que resulta em baixa fosforilação de STAT1 e, consequentemente, menor ativação dos genes relacionados à via.
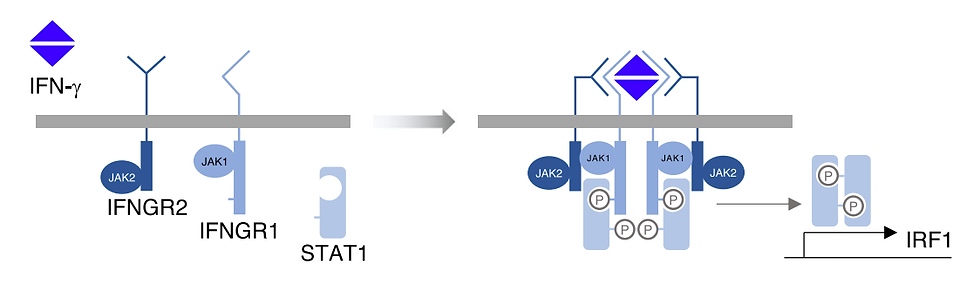
Figura 02. Representação ilustrativa da via de sinalização de IFNg. Fonte: Arenas e colaboradores (2021).
Por fim, acreditando que esta modulação de JAK2 adquirida dentre o processo de indução de resistência poderia ser devido a um fator epigenético, as células resistentes foram tratadas com diferentes moduladores epigenéticos, no qual a droga TSA (responsável pelo bloqueio da desacetilação genômica induzida por HDAC, que resulta na inibição de transcrição) foi capaz de reverter a expressão de JAK2, o qual comprovadamente demonstrou estar desacetilado em análises posteriores. Desta forma, os autores demonstraram que as células tumorais podem adquirir um perfil de resistência ao tratamento com imunoterápicos através da variação de expressão de JAK2 por fenômenos epigenéticos que resultam numa baixa eficiência à resposta citotóxica mediada por IFNg liberado por células T (figura 3).

Figura 03. Ilustração da ação biológica descrita no artigo. Fonte: Arenas e colaboradores (2021).
Nesse sentido, diversos fatores intrínsecos às imunoterapias, célula tumorais e os próprios pacientes podem estar relacionados à limitação da resposta terapêutica; o artigo é importante ao descrever um destes mecanismos, não explorado até o momento nesse contexto. Isso possibilita novas estratégias de tratamento afim de induzir melhores taxas de tratamento, além de somar ao conhecimento da fisiologia tumoral.
Referências:
1. Arenas, E.J., Martínez-Sabadell, A., Rius Ruiz, I. et al. Acquired cancer cell resistance to T cell bispecific antibodies and CAR T targeting HER2 through JAK2 down-modulation. Nat Commun 12, 1237 (2021). https://doi.org/10.1038/s41467-021-21445-4
2. Abdo, L., Aragao, E. A., Bonamino, M. Structural Determinants of Chimeric Antigen Receptor Design. Critical Reviews in Immunology;.41;1(2021). 10.1615/CritRevImmunol.2021037551
3. Springuel L, Lonez C, Alexandre B, Van Cutsem E, Machiels J-PH, Van Den Eynde M, et al. Chimeric antigen receptor-T cells for targeting solid tumors: current challenges and existing strategies. BioDrugs. (2019) 33:515–37. doi: 10.1007/s40259-019-00368-z
4. Medrano RFV, Hunger A, Mendonça SA, Barbuto JAM, Strauss BE. Immunomodulatory and antitumor effects of type I interferons and their application in cancer therapy. Oncotarget. 2017;8(41):71249-71284. Published 2017 Jul 25. doi:10.18632/oncotarget.19531





Comentários